<序論>
アスベストへの暴露は主要な悪性中皮腫の原因であり、西洋では悪性中皮腫の80%にもなる。さらにアスベストは付加的発癌性物質やあるいは遺伝的因子となりやすい。悪性中皮腫内では多段式の遺伝子発現が生じている。ヒトの悪性中皮腫はNF2のような癌抑制遺伝子の不活性化を示す。また、活性化p21キナーゼは悪性中皮腫のなかでNF2不活性化の結果として活性化される。さらに癌抑制遺伝子であるp16とp14をエンコードしているCDKN2A/ARF座のホモの欠損が、悪性中皮腫内でみられる。TP53の変異はほとんど見られなかった。癌発生で中心的役割を演じると考えられているセリンースレオニンキナーゼAKT/proteinキナーゼBの活性化は、ヒトの悪性中皮腫でも見られる。AKTの活性化は悪性中皮腫の病因で特定の癌抑制遺伝子の変性と共同していると思われる。ネズミモデルにおいてヒトの悪性中皮腫の分子変異の特徴の再現性は確立していない。そこで、アスベストを誘導した癌発生のマウスモデルを用いた。これは分子変性とともに悪性中皮腫を発達しており、人の中皮細胞の癌形成の特徴であると考えられ、キー癌抑制遺伝子の不活性化を含み、Aktの活性化を含む。このマウスモデルにより悪性中皮腫の病因をさらに明らかにし、新しい治療のデザインとなるかもしれない。
<方法>
Tp53依存性マウスとアスベストあるいはTiO2分子を導入されたNF2(+/-)マウスにおいて悪性中皮腫を誘導した。マウスは6?8週歳で、注入について合計8ラウンドで21日ごとにPBSの1ml中に400μgのアスベストを注入した。TiO2 320μgは、アスベスト線維としておおよそ同等の分子を含んでおり、同様に投与した。合計14匹のNF2(+/-)マウスと15匹のWT同腹子のマウスがTiO2を用いられ、35匹のNF2(+/-)マウスと32匹のWTマウスにアスベストを暴露させた。最初のマウスの悪性中皮腫細胞はPBSを使って、腹水や腹膜腔の洗浄水から分離した。細胞はPBSの中で洗浄され、20%FCSをもつDMEMで置き換えられ、2mmol/LのL-glutamineと10units/ml penicillin/stereptomycinで補なった。残りからの細胞は分子解析のために使った。マウスの悪性中皮腫からのDNAや全RNAはTriReagentを用いて分離した。ヒト悪性中皮腫細胞からのゲノムDNAを分離した。Western Blotting分析も行った。ゲノムDNAは最初のマウス悪性中皮腫細胞培養から分離されTp53のエキソン4?11がPCR増幅を行った。ヒトTp53のエキソン4?10はNCBIデータベース情報でデザインされたプライマーを使ってPCR増幅を行った。

<結果>
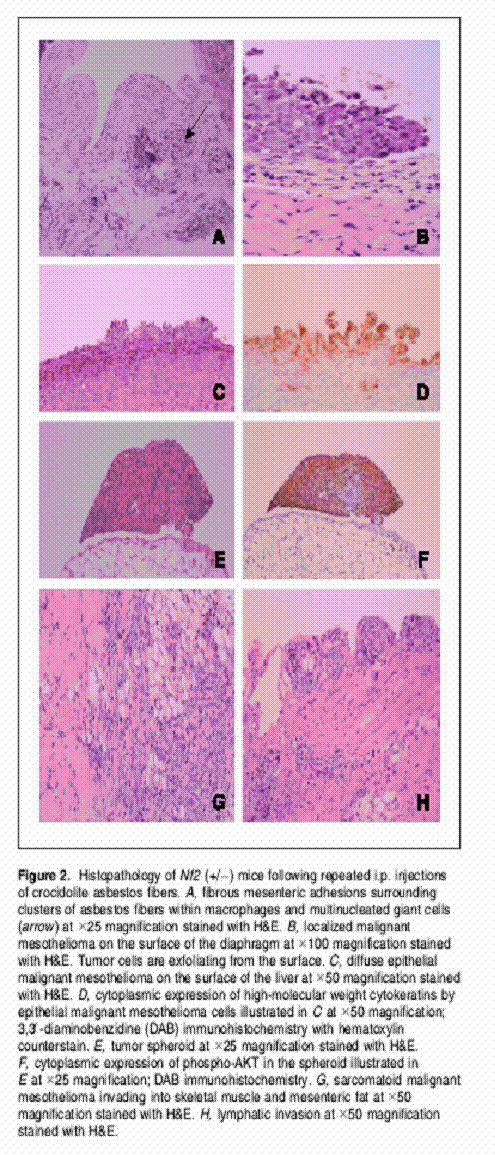
TiO2マウスのどれも悪性中皮腫を発症しないのに対して、WT同腹子と比較してアスベストに暴露させたNF2(+/-)マウスでは悪性中皮腫が加速されることを発見した。線維の癒着と腹水がNF2(+/-)マウスでは初期に発達し、腫瘍の播種と浸潤の割合がNF2(+/-)マウスにおいて加速していた。Fig2で示されているように悪性中皮腫は漿膜の表面を超えて初期には広く拡散し、引き離された物質あるいは漿液血液上の腹水に浮かんだ球として成長する。Aktは癌の重要なホールマークに貢献する細胞過程を規制する。アスベスト暴露NF2(+/-)マウスからの9つの腫瘍上でAktキナーゼの活性を認識した。
NF2(+/-)マウスから悪性中皮腫内に対立遺伝子の不活性化を発見した。Western blot分析によりNf2のアレルの不活性化は50%のアスベスト暴露WTマウスからの悪性中皮腫で見られた。そして、このより低頻度のアレルのNf2の不活性化は我々がヒト悪性中皮腫で実証したNF2のアレルの不活性化の発生数と類似していた。
アスベスト暴露NF2(+/-)マウスからの悪性中皮腫細胞は同様の腫瘍サプレッサー遺伝子のホモ欠失を示した。ゲノムとRT-PCR分析によりNf2(+/-)マウスからの悪性中皮腫67%においてp16とp19の両方の欠失を明らかとなった。P15のホモ欠失のみp16とp19のホモの喪失との結合内に生じた。NF2(+/-)マウスにおいて、Tp53の喪失はRT-PCRによって検出され、p53タンパクの喪失は9つ中4つの悪性中皮腫において免疫ブロッティングによって確認された。いかなる欠失あるいはミスセンス変異もWT Tp53を保有する悪性中皮腫細胞の培養中に見つからなかった。Tp53の表現は逆にp19を保有する初期のマウス悪性中皮腫細胞培養内で失われたことを観察した。ヒト悪性中皮腫の85%においてp16のホモ欠失をはっきりと確認した。人悪性中皮腫細胞の90%においてp14の一部あるいは全てにおいてホモ欠失を明らかとなった。マウスの悪性中皮腫と同様に、INK4a/ARF座においてホモ喪失の欠如の中では起こらなかった。TP53のエキソン4?11の分析はテストされた15%の悪性中皮腫細胞において変異を示した。同様の変異が一致する腫瘍細胞のサンプルで観察された。2つのTP53変異を持つ腫瘍サンプルはp14のホモ喪失を示さなかった。与えられた悪性中皮腫におけるp53の経路の原因はp14かp53のどちらかの中での欠損により生じたことを示したが。全体で、20の内19の悪性中皮腫のケースはp14/p53経路に影響する変異を生じた。
<考察>
NF2の生殖細胞計の変異は個々を神経外胚葉由来の腫瘍への素因となるが、体性細胞のNF2の変異もまた散発的な髄膜腫や神経鞘腫に起こり、時折無関係に悪性である。NF2の生殖系細胞の変異を持つヒトは悪性中皮腫への感受性が増加している。悪性中皮腫のNF2変性の臨床的結果はまだ定義されていない。マウスモデルにおいては、ヘテロのNf2マウスはアスベストを誘導された悪性中皮腫に対する感受性の増加を示しただけでなく、一貫して分子的原因のプロフィールを示した。それは特定の腫瘍サプレッサー遺伝子の変異とAktの活性化を含み、ヒト悪性中皮腫の特徴を再現している。
アスベストを誘導されたNf2(+/-)マウスに生じる悪性中皮腫中の強いAktの活性化は我々のヒト悪性中皮腫や、アスベストで扱われたWTマウスからの悪性中皮腫で見つかった。アスベストに暴露されたNf2(+/-)マウスからの悪性中皮腫の分析やヒト悪性中皮腫の研究は特徴的に類似の耐性細胞遺伝子変化を示し、腫瘍サプレッサー遺伝子のp16やp14/p19やp15のホモ欠失を含んでいる。さらに、マウスとヒト悪性中皮腫の両方において、同様のARF喪失/p53変異の相互関係のパターンが観察された。Western blot分析によりアスベストによる悪性中皮腫においてNf2タンパクの喪失を示し、Nf2(+/-)マウスからの悪性中皮腫で見られた発生数よりも少ないが人悪性中皮腫で報告されたNF2不活性化の頻度と類似している。これらのデータはヒトとマウスの悪性中皮腫において分子的原因の共通のセットに関係している。p53/ARFとp16細胞サイクルの定期的経路の変異とAKTとp21活性化キナーゼのシグナル導入経路はヒトとマウスの悪性中皮腫における悪性中皮腫腫瘍形成をドライブするために共同するクリティカルな出来事であるようである。これらの発見は一貫してマルチステップの過程である癌である。p14あるいはp53の変異によって悪性中皮腫細胞が不可欠な細胞サイクルのチェックポイントを回避し、保持している悪いアスベスト導入DNAダメージを分離し続けるということである。AKT経路の活性化は細胞生存を促進することによる通常細胞の増殖を調節する。P21活性化キナーゼは細胞運動性を促進し、NF2依存性悪性中皮腫におけるp21活性化キナーゼの活動を阻害する。腫瘍侵襲性において潜在的NF2の役割がアスベストを暴露したNf2(+/-)マウスにおける我々の発見によってわかった。そして悪性中皮腫の侵襲性により生存が減少した。中皮腫はWTマウスより速い割合で発達したのである。
今回アスベストと中皮腫について調べてみたが、他にもこのように人為的なものによる病気が多くあると思う。起こってしまった病気を治療することは非常に困難な場合が多い。いかに病気が起こる前に予防していくことが重要であるか、これからの医療は予防に対する取り組みがさらに重要になってくると思う。私たちは医師となるべく今後勉強を重ねていく。目の前の患者さんの病態を見るだけでなく、その患者さんの背景にあるもの、生活環境なども十分にコミュニケーションをとりながら予防という観点から病気を診ていくことが必要であると思った。